- Adv -
Il termine osteoimmunologia è un termine che è stato per la prima volta utilizzato da Arron nel 2000 per descrivere la interrelazione tra cellule ossee e sistema immunitario. Essa è ad oggi diventata un importante campo di ricerca sul metabolismo osseo, allo scopo di approfondire il crosstalk tra osso e cellule immunitarie sia in condizioni fisiologiche che patologiche ed evidenziare nuove possibilità terapeutiche.
L’osteoimmunologia, inoltre, si affianca, documentandone le basi molecolari, alla più ampia discussione sull’inflammaging, infiammazione cronica di basso livello, che è all’origine della maggior parte delle patologie degenerative, dando corpo e maggior validità scientifica alla cosiddetta oxi-inflammaging theory dell’osteoporosi.
Molti fattori immuno-correlati, come le interLeukine (ad esempio IL-1, -6, -11, -17 e -23), il Tumor Necrosis Factor, TNF-α, il Receptor-Activator of Nuclear factor Kappa B (RANK) e il suo ligando (RANKL), il fattore nucleare delle cellule T attivate citoplasmatico-1 (NFATc1) e altri sono tutti fattori cruciali nella biologia degli osteoclasti e degli osteoblasti. Tuttavia anche se l’asse sistema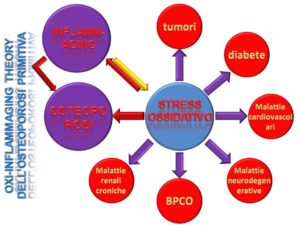 immunitario-tessuto scheletrico è ormai una conoscenza almeno in parte acquisita (il RANKL che è una citochina della ampia famiglia dei TNF è bersaglio di una risorsa terapeutica, l’anticorpo monoclonale denosumab), un po’ meno noto è che il dialogo tra il sistema immunitario e l’osso è bidirezionale, il che significa che anche le cellule ossee influenzano le cellule immunitarie. Infatti, ad esempio, gli osteoblasti contribuiscono all’impegno e alla differenziazione dei linfociti B dalle cellule staminali ematopoietiche, effetto probabilmente dovuto alla secrezione di osteoblasti di InterLeukin (IL) -7 e Stromal cell-Derived Factor (SDF) 1, sottofamiglia CXC, due citochine fondamentali per la differenziazione delle cellule B. studi sperimentali hanno dimostrato inoltre che l’eliminazione degli osteociti porta a una grave linfopenia, causata dalla perdita di stroma di supporto linfoide nel timo e nel midollo osseo, che viene ripristinata ristabilendo la popolazione osteocitaria.
immunitario-tessuto scheletrico è ormai una conoscenza almeno in parte acquisita (il RANKL che è una citochina della ampia famiglia dei TNF è bersaglio di una risorsa terapeutica, l’anticorpo monoclonale denosumab), un po’ meno noto è che il dialogo tra il sistema immunitario e l’osso è bidirezionale, il che significa che anche le cellule ossee influenzano le cellule immunitarie. Infatti, ad esempio, gli osteoblasti contribuiscono all’impegno e alla differenziazione dei linfociti B dalle cellule staminali ematopoietiche, effetto probabilmente dovuto alla secrezione di osteoblasti di InterLeukin (IL) -7 e Stromal cell-Derived Factor (SDF) 1, sottofamiglia CXC, due citochine fondamentali per la differenziazione delle cellule B. studi sperimentali hanno dimostrato inoltre che l’eliminazione degli osteociti porta a una grave linfopenia, causata dalla perdita di stroma di supporto linfoide nel timo e nel midollo osseo, che viene ripristinata ristabilendo la popolazione osteocitaria.
Tuttavia, comunque, è ben più importante e significativa l’influenza che il sistema immunitario, prevalentemente attraverso la secrezione di interleuchine, ha sul metabolismo osseo e sulle sue fasi di modellamento (accrescimento nell’età giovanile e riparazione post-fratturativa) e di rimodellamento (mantenimento di una corretta struttura ossea nel corso delle età).
È noto che alcune molecole come RANKL, M-CSF (Mcrophage-colony stimulating factor) e Osteoprotegerina siano secrete dagli osteoblasti, meno noto, invece, che 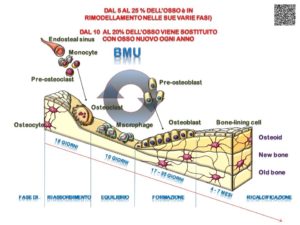 esse siano prodotte anche da cellule del sistema immunitario come, ad esempio, le cellule B, le T e le T attivate. Le cellule T sono un componente chiave dell’immunità adattativa, cellule piccole e relativamente rare che hanno un ruolo chiave non solo nell’immunità, ma anche nell’osteoimmunologia. Le cellule T non sono tutte uguali, e, tra i vari sottotipi, alcune sono in grado di influenzare il ciclo di rimodellamento osseo, prevalentemente influendo sulla maturazione, attivazione e durata di vita degli osteoclasti. Tra esse le cellule Th17 sono state messe al centro dell’attenzione per essere le cellule T che inducono più osteoclastogenesi attraverso la secrezione di citochine: L-17A, IL-17F, IL-22, IL-26 e IFN-γ. Queste cellule, inoltre, inducono la formazione del fattore di stimolazione delle colonie di macrofagi (M-CSF) e di RANKL negli osteoblasti e nelle cellule stromali, e la produzione di RANKL e TNF-α, aumentando parallelamente l’espressione di RANK nei precursori degli osteoclasti. Queste caratteristiche li rendono potenti induttori dell’osteoclastogenesi, come, d’altronde, è stato ampiamente dimostrato negli studi relativi all’artrite reumatoide. Ma anche altre cellule T e le cellule Natural Killer del sistema immunitario non mancano di produrre i loro effetti sul metabolismo osseo attraverso la secrezione di IFN-γ che influenza gli osteoblasti aumentandone i geni di differenziazione, come il fattore di trascrizione 2 correlato a Runt (Runx2), l’Osterix, la fosfatasi alcalina (ALP) e l’osteocalcina e, contrario, inibendo l’adipogenesi.
esse siano prodotte anche da cellule del sistema immunitario come, ad esempio, le cellule B, le T e le T attivate. Le cellule T sono un componente chiave dell’immunità adattativa, cellule piccole e relativamente rare che hanno un ruolo chiave non solo nell’immunità, ma anche nell’osteoimmunologia. Le cellule T non sono tutte uguali, e, tra i vari sottotipi, alcune sono in grado di influenzare il ciclo di rimodellamento osseo, prevalentemente influendo sulla maturazione, attivazione e durata di vita degli osteoclasti. Tra esse le cellule Th17 sono state messe al centro dell’attenzione per essere le cellule T che inducono più osteoclastogenesi attraverso la secrezione di citochine: L-17A, IL-17F, IL-22, IL-26 e IFN-γ. Queste cellule, inoltre, inducono la formazione del fattore di stimolazione delle colonie di macrofagi (M-CSF) e di RANKL negli osteoblasti e nelle cellule stromali, e la produzione di RANKL e TNF-α, aumentando parallelamente l’espressione di RANK nei precursori degli osteoclasti. Queste caratteristiche li rendono potenti induttori dell’osteoclastogenesi, come, d’altronde, è stato ampiamente dimostrato negli studi relativi all’artrite reumatoide. Ma anche altre cellule T e le cellule Natural Killer del sistema immunitario non mancano di produrre i loro effetti sul metabolismo osseo attraverso la secrezione di IFN-γ che influenza gli osteoblasti aumentandone i geni di differenziazione, come il fattore di trascrizione 2 correlato a Runt (Runx2), l’Osterix, la fosfatasi alcalina (ALP) e l’osteocalcina e, contrario, inibendo l’adipogenesi.
Anche sulla differenziazione degli osteoclasti sono stati raccolti numerose prove che testimoniano l’effetto inibitorio dell’IFN-γ, contrastando l’effetto dell’M-CSF sui precursori degli osteoclasti, riducendo l’espressionee portando infine a un pool ridotto di preosteoclasti in grado di procedere nel percorso di maturazione.
Una azione di stimolo degli osteoclasti è, invece, legata in maniera estremamente significativa ad altre citochine, queste ad attività pro infiammatoria, come il TNF-α e le Interleuchine 1, 6, e 17 (IL-1, IL-6, IL-17) che giuocano un ruolo fondamentale in tutte le patologie nelle quali si assiste ad un riassorbimento osseo, dall’artrite reumatoide alla malattia parodontale e, ovviamente, all’osteoporosi.
Ma quale futuro per l’osteoimmunologia? semplice terreno di ricerca confinato nelle stanze dei laboratori o supporto alla pratica clinica? In effetti la complessa interrelazione tra i diversi fattori che regolano l’osteoimmunologia che restringe il campo di applicazione dei farmaci comunemente intesi a causa della loro attività troppo intensa e spesso poco selettiva, rischia di relegarla agli aspetti puramente speculativi. Tuttavia, in tempi relativamente recenti, ha iniziato a diffondersi il concetto di Low Dose Medicine (LDM) che attraverso la somministrazione di basse dosi, in genere pg (picogrammi), è in grado di stimolare od inibire specifiche molecole allo scopo di riequilibrare il metabolismo osseo e riportare il processo di rimodellamento alla normalità. La conoscenza dei meccanismi più profondi della biochimica e quindi del rapporto sistema immunitario-tessuto osseo è però imprescindibile da una corretta applicazione di tali fattori di modulazione.